




北京远博医药CRO全部业务范围
All of our business scope for you!





总经理致辞
General Manager Address
十多年的创业历程,十多年的辛勤耕耘,造就了今日的北京远博医药。北京远博医药作为中国GCP的早期实践者,以先进的项目管理模式,过硬的质量控制体系、超强的注册审评沟通能力赢得了广大客户的信赖。
作为国内知名的CRO公司,北京远博医药一直致力于药品、医疗器械、医疗产品的临床工作,我们坚持“诚信经营,与客户共赢”的企业宗旨,以诚取信,以信立业。我们将永远履行一个CRO企业应尽的全部义务。希望与广大客户成为永远的朋友,愿我们的事业共同进步!
海以其博大,纳百川而成其浩瀚;山以其厚重,历沧桑而为之雄浑。北京远博医药CRO正以远大的志向,博大的胸怀、诚信务实的品质,敬业创新的态度,科学严谨的作风迎接临床试验外包服务的辉煌未来!
公司简介
About US

北京远博医药是致力于临床试验、科研开发、项目管理和信息咨询的优秀CRO,业务种类包括:新药(化药、中药和生物制品)Ⅰ~Ⅳ期临床试验、生物等效性(BE)研究、药代动力学(PK)、上市后再评价(学术推广)的临床试验、药物经济学评价、循证医学研究、产品指定医院(或领域学术权威专家)的推广型研究、药品上市后增加适应症临床试验、中药品种保护临床试验、医疗器械及诊断试剂的临床试验、处方药转换OTC、进口药物注册申报等。
截止目前,公司已完成和正在进行的临床研究300多项,由我公司负责临床试验并成功获得CFDA批准文号的化药品种共16个、中药7个;我们完成临床获准上市的医疗器械近20个,成功帮助企业获得近60个中药品种的保护证书;同时我们为进入2012版基药目录的6个品种提供了包括上市后再评价、Ⅳ期及药物经济学评价的临床研究服务工作。我们的临床试验专业涉及到呼吸、心脑血管、内分泌、妇科、儿科、泌尿、消化、骨科、耳鼻咽喉、皮肤、血液、口腔、外科、肿瘤、抗生素、麻醉、神经、肝病、抗过敏等诸多领域,已与二百多家医药企业建立了合作关系,在进行临床试验过程中已同400多家药物临床试验机构和三甲医院建立了合作关系。
公司长期以来与国家相关审评、审批部门的合作积累了丰富的政府资源,也与国内多个领域权威医学专家建立了良好的合作关系。公司有一套完善的、符合GCP要求的SOP和质量控制体系,是目前国内承接临床试验项目多、市场推广能力强、中西药并重、政策综合把控好的公司之一。
主营业务比例表
Main business chart




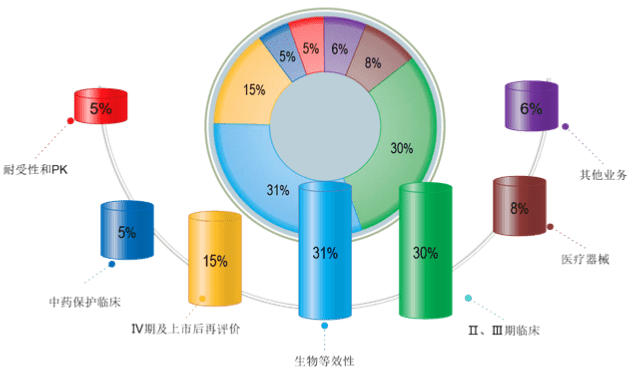

300多项临床项目的管理经验
公司建立了一套适合实际操作的SOP,结合独立的数据管理统计及稽查团队设计,既能保证质量又保证项目顺利进行
及时跟踪最新的审评动态及关注政策法规的变化
临床方案须经权威专家审核后方可实施
与400多家临床医院长期合作
主营业务特色及优势
Characters&Advantages

公司有大包模式、小包模式等多种合作模式供客户选择,可为企业合理规避风险同时提高监督效率
管理人员均有5年以上临床经验,并在公司就职3年以上,有丰富的项目管理及专业的项目沟通经验.可规避目前多数CRO由于团队不稳定导致的进度拖延及质量不可控风险
与各审评部门的权威专家有良好的沟通能力
核查通过率100%,未有真实性问题导致的退审



Why cooperate with us?
服务介绍
Client Testimonials
客户感言
“我公司的一个呼吸科的产品,疗程非常短,我们厂子自己做的Ⅱ期临床试验监查,结果失访率很高,Ⅲ期临床试验的监查交于远博公司,他们的监查员很负责,从患者的招募、筛选、知情、过程跟踪等多个环节严格监查管理,保证了试验的过程非常顺利,确保疗后数据完整,满足后期统计及注册申报的要求”
“远博的团队很稳定,我们厂一个中药新药的Ⅱ期及Ⅲ期临床试验交给他们公司组织管理,项目历经4年,项目经理及主要的监查员都没有变动,后期核查由一致负责这个项目的项目经理配合,比较得心应手,沟通也一直高效而简单”
“通过网络我们企业与北京远博进行了初次的接触,他们就给我们的项目制作了专业而详细的项目计划书,对我们企业如何开展项目,整个项目的费用和周期都有了一个完整的了解,对后续的合作奠定了良好的合作基础”
“我厂与国内多家CRO公司合作过,感觉远博医药在试验过程中对数据的动态监控非常有价值,为我们公司的投入及决策提供了重要的保障”

按照CFDA的2016年第106号公告,CFDA所列的289个产品如果不能进行BE研究的就需要进行临床有效性研究,并且要求在2021年底前必须完成。其它品种自首家品种通过一致性评价后,其他药品生产企业的相同品种原则上应在3年内完成一致性评价;逾期未完成的,不予再注册。
仿制药一致性评价技术服务
紧迫性:CFDA已经要求基本药物目录中的289个品种必须在2018年底完成,对于需要进行临床有效性研究的品种可以延长至2021年底完成。
重要性:如果不进行一致性评价,许多品种将不再能够生产及销售!同样先完成一致性评价的品种将能够获得许多政策倾斜,抢得市场先机!
一致性评价临床有效性试验
按照国务院8号文件以及国家药监总局106号的规定,在2012版国家基本药物目录中的289个品种必须进行一致性评价,按照政策要求“找不到且无法确定参比制剂的,由药品生产企业开展临床有效性试验”。而且必须在2021年底完成,CFDA在2016年9月出台了《仿制药质量和疗效一致性评价临床有效性试验一般考虑》的征求意见稿,为如何开展一致性评价的临床有效性研究提供了技术参照,为该类药物的临床试验指明了研究的方向——安慰剂对照的临床有效性评价。

我公司提供整个流程的一站性服务
北京远博医药CRO公司携大量随机对照临床有效性及安全性的临床试验的经验为客户提供如下服务:
1、制定临床有效性研究的试验计划,包括费用和周期的预算;
2、组织协调临床研究医院按照相关的要求完成整理临床试验;
3、按照要求完成整个临床有效性的研究报告。

阿仑膦酸钠片
Successful Case

我公司随机对照临床试验相关案例的展示
*出于本公司对已合作业务伙伴的信息保密,仅选择性公布部分项目案例

一致性评价临床优效性试验的合作流程
Service Process




临床试验操作经验 | |
十多年从事过大量新药、上市后再评价及中药保护的临床试验,积累了丰富的临床试验操作经验。 | 主要从事生物等效性研究,不具备临床有效性试验——大临床试验的经验。 |
安慰剂对照的临床试验操作经验 | |
既从事过大量的化药的临床试验,又从事不少中药的临床试验,具有丰富的安慰剂对照的临床试验设计及操作经验 | 主要从事化药3类新药的临床试验,主要是桥接试验,从事安慰剂对照的临床有效性研究很少 |
临床医院资源的优势 | |
十多年与超过300家药物临床试验机构进行过合作,既有大量的Ⅰ期药物临床试验机构,又有大量从事随机对照临床试验的机构资源,能够满足一致性评价临床有效性试验的要求。 | 主要与Ⅰ期药物临床试验机构进行合作,与随机对照临床试验的医院合作少。 |
政府资源的沟通 | |
找寻权威的PI,而且与政府审评专家进行沟通,为方案的设计提供强有力的帮助。 | 按照常规的临床试验的流程进行临床试验的设计。 |
公司管理的优势 | |
成立十一年以来,根据本行业的特点,组建了非常完善的团队,建立了合理严谨的项目管理体系 | 公司成立时间短,公司没有完善的管理机构 |
质量管理体系的优势 | |
根据GCP等相关政策要求制定了完善且可操作的SOP,项目经理都是从业5年以上的专业人员的担任 | 没有完善的SOP体系,仅仅依靠项目经理的经验管理项目 |
团队稳定性的优势 | |
公司给予每个人充分的培训及晋升机会,公司团队成员稳定,保证项目的顺利执行 | 公司刚成立,或者公司文化不好,公司的人员流动性过大,难以保证项目的联系进行 |
专家资源的优势 | |
公司运行十多年来,积累了丰富的专家资源,能够为客户的项目保驾护航 | 没有针对药物临床研究的专家顾问团队,无法为项目的运行提供充分的专业保障 |
灵活多样的合作模式 | |
提供多种合作模式供客户选择,可根据客户自身的特点,项目的要求等情况选择最合适的合作模式。 | 单一的大包合作模式,无法满足客户的各种需求,尤其在目前临床项目的金额和周期都特别大的情况下 |
质量保证的优势 | |
有独立的稽查部门,保证项目的质量,公司也有数据管理部门能够满足CFDA7月29日颁布指导原则的要求 | 没有独立的稽查部门,没有数据管理部门,项目的真实性难以保证 |











保妇康软胶囊
口溃清含片
双金喷雾剂
香芎冠心软胶囊
神白散
前列回康片

帕洛诺司琼注射液
阿折地平片
注射用兰索拉唑
布康唑栓
奥美拉唑碳酸氢钠胶囊
暴贝止咳口服液
双黄止咳颗粒

非布司他片
氨基乙酸丙酸搽剂
硝酸芬替康唑栓
布洛芬注射液
米格列奈钙片
卢帕他定片
芪胶胃疡胶囊

















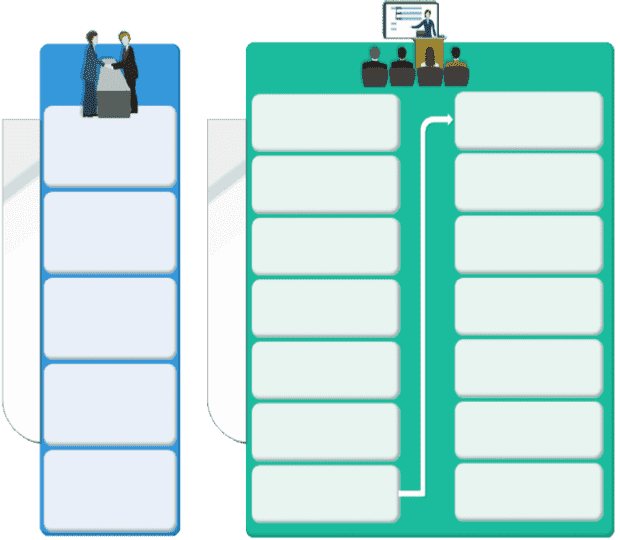
项目洽谈阶段
客户提出要一致性评价的品种
北京远博对品种进行详细调研
制作临床有效性评价的项目计划书
双方项目洽谈
签订合同项目合作
召开医院临床启动会
申办者准备药品、安慰剂及编盲等
伦理委员会审核
临床研究方案定稿
召开方案讨论会
同时起草研究方案草案等资料
联系牵头单位、参加单位及统计单位
申办者及专家审核后签字盖章
病例的收集及观察
病例观察结束关闭中心
送交统计单位进行数据录入及答疑
盲审及统计分析
召开临床总结会
项目进行阶段
撰写总结报告

项目申报阶段
向客户交接资料
省局受理资料
研究现场核查及生产现场检查(下一行)临床试验数据核查
药品检验机构复核
审评通过公示及领取批件
一致性评价办公室审评


北京远博医药CRO
© 2025北京远博医药CRO 版权所有




临床试验、一致性评价、项目管理和信息咨询专家
临床试验优先选择的CRO
专业为医药企业提供一体化专业咨询服务








