cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;cro企业,cro公司,cro,北京cro,北京cro公司,北京cro企业;
临床试验的电子数据采集 技术指导原则 (征求意见稿) 国家食品药品监督管理总局药品审评中心
《临床试验的电子数据采集技术指导原则》征求意见稿
II
目录
一、 引言 ...................................................................................................................................1
二、 电子数据采集的定义 .......................................................................................................1
三、 应用电子数据采集技术的基本考虑 ...............................................................................1
3.1数据质量与真实完整性 ........................................................................................................2
3.2 系统的风险管理 ...................................................................................................................2
3.3 生命周期 .............................................................................................................................2
3.3.1系统的生命周期 .............................................................................................................2
3.3.2项目应用的生命周期 .....................................................................................................2
四、 电子数据采集系统的基本要求 .......................................................................................3
4.1 软件 .......................................................................................................................................3
4.1.1 系统开发 ........................................................................................................................3
4.1.2 系统验证和版本控制 ....................................................................................................3
4.1.3系统的基本功能 .............................................................................................................4
4.2 硬件 .......................................................................................................................................5
4.3 人员 .......................................................................................................................................5
4.3.1系统培训 .........................................................................................................................5
4.3.2 技术支持 ........................................................................................................................5
4.4 系统的环境及使用要求 .......................................................................................................5
4.4.1 物理和网络环境 ............................................................................................................5
4.4.2数据的安全性 .................................................................................................................6
4.4.3权限控制 .........................................................................................................................6
4.4.4系统的标准操作程序 .....................................................................................................6
五、 电子数据采集系统的应用要求 .......................................................................................6
5.1 试验启动阶段 .......................................................................................................................6
5.1.1准备工作 .........................................................................................................................6
5.1.1.1申办者的准备工作 ......................................................................................................6
5.1.1.2研究机构的准备工作 ..................................................................................................7
5.1.1.3 用户技术支持 .............................................................................................................7
5.1.2 数据库的构建与测试 ....................................................................................................7
《临床试验的电子数据采集技术指导原则》征求意见稿
III
5.1.2.1 eCRF的构建及外源数据与EDC的整合 ........................................................................7
5.1.2.2 逻辑核查的设计及测试 .............................................................................................8
5.1.2.3用户认可测试 ..............................................................................................................8
5.1.2.4 eCRF填写指南 ..............................................................................................................9
5.1.3上线使用 .........................................................................................................................9
5.2试验进行阶段 ........................................................................................................................9
5.2.1数据来源 .........................................................................................................................9
5.2.2数据录入要求 .................................................................................................................9
5.2.3数据核查 ...................................................................................................................... 10
5.2.4 源文件监查 ................................................................................................................. 10
5.2.5变更控制 ...................................................................................................................... 10
5.2.6 研究者签名 ................................................................................................................. 10
5.2.7 监管机构的现场视察 ................................................................................................. 10
5.3试验结束阶段 ..................................................................................................................... 10
5.3.1数据库的锁定 .............................................................................................................. 10
5.3.1.1 核实电子签名 .......................................................................................................... 11
5.3.1.2 数据库锁定 .............................................................................................................. 11
5.3.1.3 数据库解锁 .............................................................................................................. 11
5.3.2 归档 ............................................................................................................................. 11
5.3.2.1 研究机构的归档文件 .............................................................................................. 12
5.3.2.2 申办者的归档文件 .................................................................................................. 12
六、名词解释…………………………………………………………………………………………………………………………………..13
七、参考文献(略)
《临床试验的电子数据采集技术指导原则》征求意见稿
1
临床试验的电子数据采集技术指导原则 1 2
一、引言 3
近年来随着互联网和计算机技术的不断发展,电子数据采集技术在临床试验中4 越来越多的被采用,它与传统的基于纸质的收集方式不同,具有数据及时录入、实5 时发现和纠正数据错误、加快研究进度、提高数据质量等优势,因此各国药品监管6 部门都鼓励临床试验中采用电子数据采集技术以保证数据质量。 7
为了促进我国临床试验电子数据的完整性、准确性、真实性和可靠性符合《药8 物临床试验质量管理规范》和《临床试验数据管理工作技术指南》的原则要求,有9 必要对临床试验中应用电子数据采集技术的基本考虑和原则进行明确阐释,本指导10 原则通过对电子数据采集技术的概念和基本考虑,电子数据采集系统的基本技术要11 求以及在临床试验实施不同阶段的应用要求的详细阐述,旨在帮助和指导相关各方,12 包括申办者、合同研究组织(CROs)、临床研究者等在临床试验中规范合理地应用13 电子数据采集这一技术。 14
二、电子数据采集的定义 15
电子数据采集(Electronic Data Capture, EDC)是一种基于计算机网络的用于临床16 试验数据采集的技术,通过软件、硬件、标准操作程序和人员配置的有机结合,以17 电子化的形式直接采集和传递临床数据。 18 随着信息技术的发展,移动电子设备如平板电脑、智能手机、扫描仪等已具备19 作为EDC终端的条件,EDC系统已能将基于网络的应答系统、药物警戒系统、数据20 分析和报告系统、试验药品管理系统等整合成一体;同时,国际公认的数据标准(如21 CDISC)也正在EDC中得以应用。 22
三、应用电子数据采集技术的基本考虑 23
当今时代,临床试验的各个阶段(从准备到研究结束)都离不开计算机化系统24 的辅助,而确保数据质量及其真实完整性是使用EDC系统的根本要求。 25
《临床试验的电子数据采集技术指导原则》征求意见稿
2
3.1数据质量与真实完整性 26
数据质量和真实完整性是对整个临床试验的有效性和安全性进行正确评价的基27 础,是药品监管科学的核心要素。申办者在进行电子化临床试验数据管理的过程中28 应建立完善的基于风险的质量管理体系,并遵循数据质量的ALCOA原则,即可归因29 性、易读性、同时性、原始性、准确性、持久性、完整性、一致性和可取性,,参见30 《临床试验数据管理工作技术指南》第6.2章节。 31
3.2 系统的风险管理 32
电子化系统的风险管理是对启用新的电子化系统的风险进行评估和监控的系统33 工程,对于保证临床试验的数据质量和真实完整性十分重要。风险管理的基本过程34 包括风险严重性的评估、出现风险的可能性分析、实际风险的监测、风险的防御和35 矫正等方面。 36
3.3 生命周期 37
EDC的生命周期包括两个方面,即EDC系统本身的从开发到退役的整个过程,38 和投入运行后的EDC系统在服务于临床试验项目过程中的运营周期。 39
3.3.1系统的生命周期 40
一个计算机化系统有自身的生命周期,历经开发、运用、维护和退役等多个阶41 段。EDC系统的生命周期包括:立项、用户需求、系统需求、系统设计、系统开发、42 系统测试、系统发布、系统维护更新、系统退役等。计算机系统的生命周期规范是43 要确保系统自始至终都保持着被验证过的状态。 44
3.3.2项目应用的生命周期 45
申办者在选择EDC系统时,应对系统进行严格的评估和审查,以确保用于临床46 试验的EDC系统符合本指导原则的要求。EDC系统服务商应能提供完整、规范的系47 统验证文档,并在投入实际项目运营前完成用户认可测试。 48 项目应用的生命周期包括但不限于:eCRF构建、系统设置、用户认可测试、数49 据采集、数据核查、数据锁库、数据导出、数据及系统保存、系统下线等。 50
《临床试验的电子数据采集技术指导原则》征求意见稿
3
四、电子数据采集系统的基本要求 51
EDC系统作为一种计算机化系统,由所有相关的软硬件及其配套环境组成,包52 括功能性软件、配套的硬件设施、研发和使用人员的资历和培训、设备运行管理(如53 标准操作程序、维护等)及系统应用环境(如变更管理和安全保障、后台数据存储54 要求和管理、不同系统间的数据交换管理及其程序)等。 55
4.1 软件 56
4.1.1 系统开发 57
在系统开发之前,开发者要对系统的整体构架、运行环境、底层数据库结构、58 用户需求、功能模块、技术参数等制定周密的开发计划,并在开发过程中严格按照59 计划执行。开发过程中对计划的任何修改或补充、开发日志、测试记录、验证计划60 和记录、系统发布文件等均需存档备案。开发者必须建立系统开发规程及其文件审61 批程序,并存档备查。 62
4.1.2 系统验证和版本控制 63
系统验证必须在EDC系统上线运行(包括系统升级版本或升级相关模块)之前完64 成。系统验证必须有标准操作程序,并对涉及的人员及相应的职责明确规定。系统65 验证的相关文档必须齐全,包括: 66
– 系统验证计划书 67
– 系统测试脚本 68
– 系统测试结果 69
– 系统测试报告 70
– 系统验证证书 71
开发者应当建立版本更改控制操作规范,避免未授权的系统变更及其运用。EDC72 升级时,必须对前一版本完全兼容,确保系统升级后能正确地读取原有数据,而不73 会对原有数据造成任何破坏或丢失。74
《临床试验的电子数据采集技术指导原则》征求意见稿
4
4.1.3系统的基本功能 75
4.1.3.1 eCRF构建 76
EDC系统应具有生成符合临床试验方案的电子临床病例报告表(eCRF)的功能,77 并能注释eCRF,且提供eCRF填写指南。78
4.1.3.2数据保存和稽查轨迹 79
EDC系统一旦保存输入的数据后,系统不应当允许任何用户对输入的数据进行80 删改。稽查轨迹包括 81
– 用户每次登录的日期和时间,登录IP地址,操作内容,操作者; 82
– 数据的初始值,产生时间及操作者; 83
– 数据的任何修改日期和时间,修改原因,操作者。 84
稽查轨迹应不容许从系统中被删除或修改。 85
4.1.3.3逻辑核查 86
EDC系统的最大的优势是在数据进入系统时,能够对数据进行实时自动逻辑核87 查,比如数据值的范围、逻辑关系等。自动核查的条目根据不同临床试验的具体情88 况在数据核查计划中制定。EDC系统应具备构建逻辑核查功能模块。 89
4.1.3.4 数据质疑管理 90
EDC系统应该配置临床试验数据质疑产生、发布、关闭功能模块。数据管理员91 和/或临床监查员经授权后可以通过质疑管理模块将数据质疑发布给临床研究中心;92 临床研究中心对有质疑的数据进行确认、解释或更正;数据管理员根据答复情况来93 决定是否关闭该数据质疑或将答复质疑不符要求的数据再质疑。数据质疑记录痕迹94 亦应保存在稽查轨迹中。 95
4.1.3.5源数据核查确认 96
源数据确认是确保临床数据真实完整性的必要措施之一。临床监查员负责对保97 存在EDC系统中的数据进行源数据核查。源数据确认可借助系统的数据质疑功能完98 成。EDC系统应具备对已确认的数据进行标注、暂时锁定和解除锁定功能。 99
4.1.3.6电子签名 100
EDC系统应具有电子签名功能,其适用于要求电子签名的所有电子记录,包括101
《临床试验的电子数据采集技术指导原则》征求意见稿
5
产生、修正、维护、存档、复原或传递的任何形式的电子表格。电子签名可采用登102 录密码加系统随机产生的授权码来实现。电子签名与手写签名的关联性和法律等效103 性应当在被授权用户实施电子签名前声明并确认,被授权的电子签名与其书面手写104 签名具有同等的法律效应。 105
4.1.3.7数据库的锁定 106
临床数据清理工作完成后,EDC系统应当具备数据库永久锁定的功能。 107
4.1.3.8数据存储和导出 108
EDC系统应当能储存、导出符合临床试验稽查要求、药品审评要求的数据格式。 109
4.2 硬件 110
采用EDC系统需考量终端计算机条件是否满足系统的环境运行要求,如操作系111 统、数据库管理系统、浏览器、中央处理器(CPU)速率、网络或系统负载配置及112 其响应速度、硬盘与内存大小、多媒体数据支持功能配置需求(图像、视频、声音113 等)等。硬件监控管理规程也应当在标准操作程序的规范下进行。114
4.3 人员 115
4.3.1系统培训 116
EDC系统在投入临床试验项目运行之前,申办者或其委托的第三方应及时组织117 实施对所有EDC系统使用人员的培训。培训材料如EDC系统的使用指南等应由EDC118 供应商提供。适时、充分的培训是正确操作EDC系统的关键。系统使用人员培训合119 格后才能获得相应的使用权限。培训记录必须存档备查。 120
4.3.2 技术支持 121
申办者或其委托的第三方应提供全天候的系统技术支持,以确保临床试验的顺122 利进行。 123
4.4 系统的环境及使用要求 124
4.4.1 物理和网络环境 125
系统应安装在安全的物理环境中,物理环境的安全性一般可通过如下措施得以126
《临床试验的电子数据采集技术指导原则》征求意见稿
6
保障:对载体接触人员的限制、记录和监控;双电源或UPS;防震、防火、防水、127 防热、防潮(非主观的);防破坏、防盗窃(主观的)等。 128 系统的网络环境,即数据传输的电子网络(如互联网或局域网)所处的环境,129 亦应保证安全,一般可通过如下措施得以保障:建立防火墙或其他软硬件等以防病130 毒、木马、黑客、间谍软件入侵。 131
4.4.2数据的安全性 132
系统服务器及其数据库应优先考虑远程或异地备份,以确保系统运行的连续性133 和数据的安全性。当无法实现时,应使用离线备份装置定期备份并带离在线备份的134 物理环境。 135 如因不可抗力或不可控因素造成EDC系统运行中断时,EDC供应商应有相应的136 应急预案,并根据服务器和数据库备份,使EDC系统在最短时间内恢复正常运作。 137
4.4.3权限控制 138
EDC系统应具备用户管理、角色管理和权限管理功能模块。 139 EDC系统的所有用户必须拥有唯一的用户名和密码组合。密码在系统内部必须140 以加密方式存储。也可以用动态口令卡、USB-KEY数字证书、生物学标记(如指纹)141 等更高级别的安全措施来替代密码。 142
4.4.4系统的标准操作程序 143
无论是EDC系统的服务供应商还是用户都应当建立管理EDC服务、运营和维护144 的SOP,并在实际使用和管理中遵循SOP。所有执行或实施SOP的记录需存档备查。 145
五、电子数据采集系统的应用要求 146
5.1 试验启动阶段 147
5.1.1准备工作 148
5.1.1.1申办者的准备工作 149
在采用EDC系统开展试验启动阶段,申办者应做好相应的准备工作,确保参与150 研究的所有工作人员接受相应的培训以胜任各自所承担的工作,保证临床试验的顺151
《临床试验的电子数据采集技术指导原则》征求意见稿
7
利实施和质量控制。 152
5.1.1.2研究机构的准备工作 153
临床研究机构应在试验开始前应做好相应的准备工作,包括机构的网络环境、154 计算机设备、硬件、软件的准备, EDC操作人员的培训、以及文档、病历管理的SOP155 的准备等。良好的网络环境是临床机构使用EDC系统的前提。EDC系统操作人员应156 受到培训,并具备足够的经验去完成EDC中的角色所规定的职责。 157
5.1.1.3 用户技术支持 158
申办者或其委托的第三方应为EDC系统用户提供及时有效的技术支持。EDC系159 统的操作人员能在第一时间联系到技术支持人员;技术支持在合理的时间内能够解160 决问题,如忘记密码、权限管理错误、无法解决的录入错误等。用户技术支持可以161 采用在线帮助和热线电话等方式。技术支持人员要在试验开始前签署系统技术支持162 服务协议或合同。 163
5.1.2 数据库的构建与测试 164
数据库的建立及用户测试要在研究项目招募第一个受试者之前完成。研究中心165 的准备、用户权限设置、相关培训和用户技术支持等工作也需在招募受试者之前完166 成。 167
5.1.2.1 eCRF的构建及外源数据与EDC的整合 168
数据管理员在设计eCRF时,应严格依据研究方案收集与研究分析内容相关的169 数据点。eCRF设计时应考虑到对受试者隐私的保护。数据管理员对所需采集的数据170 点应预先定义并制定说明文档。 171 EDC系统建库完成后应进行自我测试。自我测试由数据管理建库人员进行,以172 确保所建系统的各个程序正确运行。 173
临床试验中需要收集很多病例报告表以外的数据,这些数据可以通过第三方供174 应商以电子化数据的形式传输到EDC系统。在设计外部数据整合说明时需要定义数175 据传输所需的数据点及相对应变量,并确定完整的变量列表。变量列表应包括对每176 一个变量类型的定义,如数值型、字符型、日期型等。同时需要对特殊字符和绝对值177
《临床试验的电子数据采集技术指导原则》征求意见稿
8
进行明确定义。传输协议应约定传输的方法和频率,并且应对数据传输失败的情况178 如何进行重新传输有明确的规定。 179
5.1.2.2 逻辑核查的设计及测试 180
逻辑核查是 EDC系统针对数据库数据的完整性、一致性和准确性而进行的核查181 方式,可采用自动逻辑核查与人工逻辑核查两种方式。数据管理人员需结合所应用182 EDC系统特点并根据项目实际要求进行逻辑程序的设计。当遇到不合理数据时,系183 统不能阻止数据的继续录入,也不能误导研究者录入所谓“正确”的数据。 184
5.1.2.3用户认可测试 185
用户认可测试由申办者负责,由EDC系统的使用者,如数据管理员进行测试,186 将模拟数据录入EDC系统,测试系统是否按照设计要求对所有数据正确储存、逻辑187 核查正确执行、外源数据能与EDC系统正确整合。在招募第一个受试者之前数据管188 理员需要完成全部测试,测试流程由下列步骤组成:准备测试计划书,输入测试数189 据,执行测试,签署、确认及归档测试结果。 190 数据库测试191 数据管理员应当在测试数据库之前制定测试计划书,测试系统功能是否与前期192 设计及说明书一致。测试内容包括:浏览及录入页面设计,各个访视顺序、访视中193 的录入表格顺序及每个数据点的顺序;不同用户浏览权限的准确性等等。 194 逻辑核查测试195 数据管理员还需要测试EDC系统能否按照预先设计准确执行质疑提示的触发和196 关闭。测试时需考虑尽可能多的逻辑情况,用正确和非正确的数据反复测试触发功197 能。同时要测试质疑信息的文字与预先制定的设计说明文档是否一致。 198 外源数据与EDC系统整合测试 199 数据管理员还需要测试外源数据与EDC系统整合的正确性,可能包括医学编码200 系统、互动语音/网络应答系统(IVRS/IWRS)、受试者报告结果(ePRO)、中心实201 验室数据等。数据管理员需依据传输协议要求,测试外源数据能否正确完整地导入202 EDC系统。任何一种影响外源数据及EDC数据的关键变量的改变都可能导致数据整203 合失败,因此,任何外源数据库或EDC数据库结构改变后,都应重新进行测试。 204
《临床试验的电子数据采集技术指导原则》征求意见稿
9
5.1.2.4 eCRF填写指南 210
签字与存档205 每一步测试内容及结果需要测试人员签字确认并存档。对每一次程序修改,测206 试人员都要对更改部分以及与更改内容相关的数据点重新进行全面测试并签字、确207 认及存档。全部测试结束后,申办者相关负责人员需要签字确认核查总结报告并存208 档。 209
eCRF填写指南是提供给研究人员有关如何正确填写病例报告表的填写细则。填211 写指南应清晰易懂,对每页表格及各数据点的都应有具体说明,强调EDC系统的功212 能与安全、操作注意事项和技术支持信息,明确说明电子签名的使用方法和要求、213 数据更改及填写的正确方式,并明确有特殊要求数据的填写规则。 214
5.1.3上线使用 215
当电子病例报告表、逻辑核查和数据库的设计开发完毕,数据管理员需确认所216 有设计开发步骤成功通过用户测试,确认所有设计文档和测试文档最终签字、存档。217 一切准备就绪,EDC数据库即可上线。 218
5.2试验进行阶段 219
5.2.1数据来源 220
源数据包括研究者检查获取的、仪器自动采集的以及受试者日志等,可是纸质221 来源,也可是电子来源。采集的方式包括通过终端的人工录入或自动载入数据库。 222
5.2.2数据录入要求 223
研究人员需按照GCP和研究方案要求来收集受试者数据,同时依据申办者制定224 的填写指南准确、及时、完整、规范地填写eCRF。 225 研究者必须保存研究记录和数据,包括电子源数据和电子文档。每个数据点都226 必须在研究中心有原始文档支持。凡被作为原始信息的记录或者文档(即受试者原227 始数据)需妥善保管以供申办者的稽查及监管部门的视察。 228 临床试验收集的数据需在每次访视的研究评价后依据项目要求尽快录入数据库。229 具体录入时限要求一般由申办者在数据管理计划中详细规定。 230
《临床试验的电子数据采集技术指导原则》征求意见稿
10
5.2.3数据核查 231
对于采用EDC技术的临床试验,数据核查与纸质研究不同的是,数据管理员应232 确保外源数据及时上传至EDC系统数据库并在规定时间内完成数据一致性核查。常233 见的外源数据核查包括实验室外源数据与上传EDC系统数据的核查、电子日志与上234 传EDC系统数据的核查、互动式语音应答系统与上传EDC系统数据的核查等。 235 数据核查的其他内容与流程参见《临床试验数据管理工作技术指南》。 236
5.2.4 源文件监查 237
研究中心应该根据监管要求保留源文件。源文件监察可以在现场进行,也可以238 远程进行。临床监察员根据相关源文件的原件或拷贝件进行源文件监察,并在EDC239 系统内或监察报表中记录监察进度。 240
5.2.5变更控制 241
EDC在使用中变更的原因一般来自两个方面:系统更新或研究方案的修订所导242 致的数据采集发生变化。变更过程须严格控制,详细记录变更内容、开始日期、结243 束日期,并确保原有数据无损。变更后的系统应在测试环境中完成充分测试后,重244 新发布到使用环境中并及时以适当的途径告知所有系统使用人员。 245
5.2.6 研究者签名 246
在数据录入完成,并且所有数据质疑都已关闭后,研究者在EDC系统里对eCRF247 做电子签名。签名后EDC系统一般不再允许数据改动。如果签名后有任何数据改动,248 则电子签名无效。 249
5.2.7 监管机构的现场视察 250
临床试验进行中的现场视察,应在EDC系统中为视察人员分配仅限浏览功能的251 用户权限,视察工作结束后应及时关闭该权限。 252
5.3试验结束阶段 253
5.3.1数据库的锁定 254
无论是基于纸质CRF的临床试验还是基于EDC系统的临床试验,数据库锁定都255 是临床试验中的一个重要里程碑。数据库锁定前,必须完成既定的数据库锁定清单256
《临床试验的电子数据采集技术指导原则》征求意见稿
11
中要求的所有任务(参见《临床试验数据管理工作技术指南》第5.11章节),同时257 要最终核实研究者的电子签名。 258
5.3.1.1 核实电子签名 259
使用EDC系统的研究,要在数据库锁定之前,核实研究者在eCRF上的电子签260 名,以确认eCRF的数据是完整的和准确的。如果在已经签名的eCRF上改动某个数261 据,研究者必须在该eCRF上重新签名。 262
5.3.1.2 数据库锁定 263
EDC系统应该具备数据锁定的功能,以防止核查过或确认过的清洁数据被更改。264 数据库锁定的条件和流程应遵守数据库锁定的SOP。当完成了数据库锁定清单的所265 有任务,核实了研究者的电子签名,完成了数据质量评估(参见《临床试验数据管266 理工作技术指南》第6.2章节),数据库锁定得到批准,并通知试验相关人员之后,267 尚可正式进行整个数据库的锁定,取消所有用户对数据的编辑权限。锁定后的数据268 可以用作最终分析和归档。 269
5.3.1.3 数据库解锁 270
EDC系统应该具备数据解锁功能,以允许对锁定后的数据进行必要的更改。电271 子病例报告表归档后,数据库一般不得解锁,如需解锁,其解锁条件和流程必须执272 行相应的SOP,且解锁的过程必须谨慎控制,仔细记录。具体处理与记录参见《临273 床试验数据管理工作技术指南》第5.11章节。 274
5.3.2 归档 275
临床试验数据(包括原始病历,源文件等)的归档应当严格遵守GCP以及法规276 的要求。 277 在EDC数据库最终锁定后,即可对eCRF进行归档。归档文件应包括整个试验278 过程中收集到的所有受试者的数据及其稽查轨迹, 以确保自数据库创建后,在EDC279 系统中发生的所有数据的录入和修改都有保存和记录,以便稽查时数据的重建。 280 临床试验结束后将关闭EDC系统,如监管机构进行现场视察,应向视察人员提281 供所要求的归档文件,以重现试验的数据管理过程。 282
《临床试验的电子数据采集技术指导原则》征求意见稿
12
5.3.2.1 研究机构的归档文件 283
研究结束后,申办者将归档的eCRF存储在比较持久的、且不能进行编辑的储284 存介质中,并交研究机构保存。机构应以签名的方式确认接收,该签字文档也应归285 档备查。研究机构应按法规要求保存相关文档,基于EDC系统的临床试验应保存PDF286 格式的eCRF,申办者要确保提供给研究机构的eCRF的质量,其它保存的文件参照287 GCP的要求。 288
5.3.2.2 申办者的归档文件 289
采用EDC系统进行的临床试验,除了GCP对临床试验文件保存的要求外, 还290 要保存以下的文档,但不限于: 291
数据管理计划书和数据管理总结报告 292
数据核查计划 293
用于统计分析的清洁数据库 294
eCRF构建的全套内容,包含eCRF表单、逻辑核查、衍生变量等 295
空白的eCRF和注释eCRF(PDF格式) 296
每个受试者完整的、含有稽查轨迹的eCRF(PDF格式) 297
系统用户历史列表,记录整个项目实施期间用户的创建及权限分配 298
每一研究机构收到eCRF归档的确认函 299
EDC用户手册、eCRF填写指南 300
与EDC系统和流程相关的SOP 301
EDC 系统的验证文件 302
EDC系统用户认可测试文件 303
各机构研究者的电子签名声明 304
研究过程中的EDC系统的变更(如系统升级,eCRF版本升级等)的测试305 文件与再上线通告 306
与EDC系统恢复有关的文件 307
EDC 系统技术支持服务协议或合同 308
申办者和研究人员的培训材料与培训记录等培训证明文件 309
《临床试验的电子数据采集技术指导原则》征求意见稿
13
锁定后研究数据的更改记录 310
稽查轨迹 311
用户权限历史记录(所有 EDC 系统用户的用户名,访问权限,及其发布、312 更改,或失活的日期) 313
灾难恢复过程的相关文件 314
研究过程中的应急计划的相关文件 315
由于归档eCRF中通常会包括多种不同格式的数据信息,因此归档文件也最可316 能采用多种文件格式,并在不能进行编辑的储存介质中保存。常用的归档格式参见317 《临床试验数据管理工作技术指南》第5.13章节。 318
六、名词解释 319 计算机化系统 (Computerized System): 临床试验中计算机化系统不单单是指320 计算机运用本身。计算机化系统中的“系统”意味着一个与临床研究过程有关的各321 个功能性软件和硬件配置环境,包括与之相配合的人员、设备、政策和程序等。从322 计算机化系统的生命周期而言,它涉及到计算机化系统的建立、验证、维护、运营、323 变更管理、退役和相关数据申报等规程及其相呼应的人员资质和培训,系统环境管324 理的标准操作规范和安全措施等药政规范要求。从临床试验中的计算机化系统的运325 用生命周期而言,计算机化系统就是一个以电子表格的形式用于建立、修正、维护、326 存档、检索或传输临床数据的电子信息系统及其与之管理相关的人员和系统运营环327 境体系。 328 版本控制 (Version Control):是计算机软件开发过程中常见的标准管理方法329 之一,用来追踪、维护源码、文件以及设定档等的改动,并且提供控制这些改动控330 制权的程序。最简单的版本控制方法就是给完成的软件程式编号,确保不同人员所331 编辑的同一程式档案都得到同步。 332
系统验证 (System Validation):意旨建立计算机化系统生命周期管理的文档333 化证据,以确保计算机化系统的开发,实施,操作以及维护等环节自始至终都能够334 高度满足其预设的各种系统技术标准、使用目的和质量属性,和处于监控的质量管335 理管理规程中,并能在其投入应用直至退役过程中都能高度再现和维护系统的标准336
《临床试验的电子数据采集技术指导原则》征求意见稿
14
和功能符合监管要求。 337 测试脚本(Test Script):用于验证计算机运用软件能满足设计的需求和检测338 软件执行功能中可能存在的错误所设定的系列特定测试指令。这些测试指令可以手339 工的方式进行测试(此时称之为测试用例),或被自动化测试工具执行。根据特定测340 试目标或条件,如执行特定的程序路径,或是验证与特定需求的一致性等,其通常341 由预设的一组输入值、执行入口条件(如角色权限)、预期结果、实际结果和执行出342 口条件(如通过否)所组成。 343 注释eCRF (Annotated eCRF): 在空白的临床试验病例报告表中记录所收集数344 据位置的注释,即标示在病例报告表数据库中数据集及其变量名所含每个数据点的345 位置。 346 稽查轨迹 (Audit Trail): 是计算机系统(如数据管理系统)的基本功能。347 意旨系统采用安全的和计算机产生的带有时间烙印的电子记录,以便能够独立追溯348 系统用户输入、修改或删除每一条电子电子数据记录的日期,时间,以及修改原因,349 以便日后数据的重现。任何记录的改变都不会使过去的记录被掩盖或消失。只要受350 试者的电子记录保存不变,这类稽查轨迹文档记录就应当始终保留,并可供监管视351 察或稽查员审阅和复制。 352 逻辑核查(Edit Check):意旨临床试验数据输入计算机系统后对数据有效性的353 检查。这种核查可以通过系统的程序逻辑,子程序和数学方程式等方法实现,主要354 评价输入的数据域与其预期的数值逻辑、数值范围或数值属性等方面是否存在错误。 355 源数据核查确认(Source Data Verification,SDV): 意旨评价记录在临床试356 验病例报告表中的数据与源数据一致性的行为,以确保所收集数据的完整性、准确357 性和可靠性,使得临床试验项目日后重现成为可能。 358 电子签名 (Electronic Signature): 电子签名是指任何用电子文件手段(如359 符号或一系列符号所组成的数据集)的形式所含或所附用于识别签名人身份的签名。360 这种由个人执行、采用或授权使用的电子签名与其手写签名具有同样法律效力。在361 临床试验中,对任何试验数据和文件的电子签名表明这个电子签名人已经接受或认362 可了其签署的相关电子记录文件内容或数据、符号或程序。 363
权限控制 (Access Control): 意旨按照临床试验电子系统的用户身份及其归364
《临床试验的电子数据采集技术指导原则》征求意见稿
15
属的某项定义组的身份来允许、限制或禁止其对系统的登录或使用,或对系统中某365 项信息资源项的访问、输入、修改、浏览能力的技术控制。 366 服务协议(Service Level Agreement, SLA):是服务合同的一个组成部分,367 是服务的提供方与用户之间在一定预算内,就服务的范围、质量要求、可靠性和职368 责等方面所达成的双方共同认可的协议或契约。服务协议通常是保证服务质量的主369 要依据。服务协议是法律文档,内容应包括所涉及服务的细则、服务支持内容、未370 能提供所需服务时的补救措施或惩罚条款、客户服务和软件硬件支持细则及费用等。 371 系统上线(System Go Live):系统上线是系统在完成创建、验证、检测步骤372 后第一次正式开始运行,使用者可以开始使用该系统进行实际业务操作。 373 外部数据(External Data):是由外部数据提供方采集的数据。外部数据可以374 通过电子数据上传或数据直接对接的方式传输到临床数据管理系统,经过数据整合375 后再进行分析;也可以不与临床数据库中的数据整合,在数据分析时,作为一份独376 立的数据源,与临床数据库内的数据一起直接参与数据分析。外部数据包括多种数377 据来源,多数为打包上传的电子数据,非纸质记录或直接录入到EDC系统的数据。 378 用户接受测试(User Acceptance Test, UAT):用户接受测试是由临床数据管379 理系统的用户进行的一种检测方式,检测记录可用以证明所设计系统经过了相关的380 验证过程。用户应全面检测所有正确和错误数据组合,记录检测结果。全面的检测381 文档应包括验证方案、测试细则记录、测试总结报告和验证总结报告等。 382 源数据(Source Data):临床研究中记录了临床症状、观测值和用于重建和评383 估该研究的其他活动的原始记录和核证副本上的所有信息。源数据包含在源文件中384 (包括原始记录或其有效副本)。 385 核证副本 (Certified Copy):核证副本是通过审核后的原始信息,是具有签386 名及签署日期的原始文件的副本,可以是纸质版或电子版。核证副本与原件具有同387 等效力。 388
变更控制(Change Control):指EDC在使用中进行变更时对变更过程的控制。389 变更的原因一般来自两个方面:系统更新或研究方案的修订所导致的数据采集发生390 变化。变更过程应事先严格规划,事后详细记录。规划中应明确变更的内容,指定391 具体实施的人员、方法和步骤;记录中应包括开始日期、变更实施过程中的规划偏392
《临床试验的电子数据采集技术指导原则》征求意见稿
16
离和应对措施以及最后的处理结果、结束日期–此即所谓的过程控制。变更控制的393 主要目的有两个方面:确保原有数据无损;变更后的EDC满足预期的要求。 394 测试环境(Testing Environment):指EDC在建立完成后,正式上线前对其硬395 软件和网路根据研究方案和数据采集特点进行测试的环境。测试环境中使用的软件396 应与生产环境中的一致,以确保测试环境中的测试结果完全反映在生产环境中,但397 测试环境中还可包括方便测试的分析工具等。测试的内容通常包括系统的功能测试,398 如稽查轨迹、质疑过程管理、角色权限等;还可以包括(但不是必须的)数据核查399 测试。 400 生产环境(Production Environment):指EDC在测试环境中完成测试后正式401 上线进入实际应用的环境。测试环境和生产环境可以是同一个环境,这时,测试人402 员应确保测试完成后,所有在测试环境中留存的测试数据、分析工具等在正式上线403 前得以全部清空,使系统进入实际应用的初始状态。 404 数据库锁定:数据库锁定为数据管理员依据数据管理计划(DMP)关闭临床试405 验数据库,使之无法更改。它是在临床试验结束、EDC系统的所有质疑被解决、经406 相关批准手续后,由数据管理员实施。被锁定的数据库 一般不得改变。 407 数据库解锁:数据库解锁即数据管理员依据数据管理计划(DMP),打开已锁定408 的数据库。只有在发现一些重要的数据问题方可解锁,如安全性数据的一致性问题409 等。一般性数据错误可不必对数据库解锁,附以说明文件即可。数据库解锁是反映410 数据管理质量的优劣,不得轻易进行。 411 储存介质:储存临床数据的各类载体,常见的载体为计算机硬盘、光盘等。 412 数据管理计划书:数据管理计划(DMP)是由数据管理员依据临床试验方案书写413 的一份动态文件,它详细、全面地规定并记录某一特定临床试验的数据管理任务,414 包括人员角色、工作内容、操作规范等。DMP的修订与升级伴随整个试验阶段。 415 数据管理总结报告:数据管理总结是在临床研究结束后,数据管理员撰写的研416 究项目数据管理全过程的工作总结,通常以定性和定量的参数来表达,如数据量、417 疑问数等。 418
数据核查计划(Data Verification Plan, DVP):数据核查计划,也称逻辑核419 查计划,是由数据管理员为检查数据的逻辑性,依据临床试验方案以及系统功能而420
《临床试验的电子数据采集技术指导原则》征求意见稿
17
撰写的系统设置文件。它由项目成员参与讨论确定,EDC系统将据此发出质疑。DVP421 是EDC系统的最重要文件之一,可作为DMP的附件或单独成文。 422 衍生变量:衍生变量是经原始数据转化而来的变量,如受试者的年龄可以由知423 情同意书签署日期减去该受试者的出生日期转化而来。 424 应急计划和灾难恢复计划:数据管理员与相关人员对可能导致EDC系统运行中425 断的灾难事故进行预估,并据此撰写的制定相关对策的文件,以保证临床数据不会426 丢失的安全以及试验的顺利实施。本计划包括对人员、软硬件设施的要求;同时预427 估发生重大的数据丢失事件时,撰写数据恢复的对策计划,以尽可能不出现或减少428 出现数据的丢失。 429
七、参考文献 (略) 430



临床试验的电子数据采集技术指导原则(征求意见稿)
2016年3月18日发布

地址:北京市丰台区西四环南路35号中都科技大厦10层
《互联网药品信息服务资格证书》 编号:(京)一非经营性一2015一0014
备案序号:京ICP备12047146号和京ICP备16030590号 信息产业部备案管理系统网址

扫
一
扫
© 2025北京远博康惠医药信息咨询有限公司 版权所有
北京远博医药CRO
感谢您关注远博医药微信公众号


© 2025北京远博恒康医药科技有限公司 版权所有

商务拓展部(药品&器械)袁经理
电话:010-
邮箱:ybkj045@126.com
人力资源部主任
电话:13146546661
邮箱:ybkj010@126.com
商务总监(药品&器械)薛总
电话:13810708945
邮箱:ybkj027@126.com


◆丰富的临床试验服务经验:
◆熟悉政策法规及审评动态:
◆良好的专家关系:
◆大量临床医院的资源:
◆专业的数据管理:
CRO:Contract Research Organization, 出现于上世纪80年代,一种学术性或商业性的科学机构。申办者可委托其执行临床试验中的某些工作和任务,此种委托必须作出书面规定,其目的是通过合同形式向制药企业提供新药临床服务的专业公司。CRO 可以作为制药企业的一种可借用的外部资源,可在短时间内迅速组织起一个具有高度专业化的和具有丰富临床经验的临床队伍,并能降低整个制药企业的管理费用。
 了解更多了解更多
了解更多了解更多

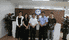






我公司承接国内外厂家或公司的委托,从事药物、医疗器械临床代理服务,以下是我公司服务过的部分项目的名称。














北京远博医药CRO成立于2005年,为医疗企业提供临床试验、项目申报、项目管理和信息咨询等的专业化外包服务(CRO服务),主要为专业化服务内容包括:新药(化药、中药和生物制品)的Ⅰ~Ⅳ临床试验、药代动力学(PK)、生物等效性(BE)、医疗器械的临床试验、上市后再评价、中药保护临床试验、药物经济学等项目的监查及项目管理。
专业化人才优势
绝大多数员工拥有专科以上学历
高标准质量管理体系
必须通过国家药监局高级研修学院的GCP培训并获得证书
完善的培训系统
注重对员工的技术培训,积极参加国家药监总局、药审中心、器械审评中心及各学术团体举办的专业培训及会议;
◆丰富的临床试验服务经验:
◆熟悉政策法规及审评动态:
◆良好的专家关系:
◆大量临床医院的资源:
◆专业的数据管理:
◆优秀而稳定的团队:
◆完善的标准操作流程:
◆独立的质量保障部门:
◆灵活多样的服务方式:

































































































































































































































 预约上门洽谈免费项目咨询
预约上门洽谈免费项目咨询CRO

北京远博医药

临床试验、一致性评价、BE研究和技术服务的专家
专业为医药企业提供一体化的专业技术服务



临床试验优先选择的CRO
18618362640
010-
全国客服热线